Por favor, avalie esta postagem
Estas são células infectadas com reovírus (glóbulos rosa). Laboratório de Microbiologia da Natureza/Dermody
Os vírus são parasitas intracelulares que causam doenças ao infectar as células do corpo e, em um estudo publicado hoje na Nature Microbiology, pesquisadores do Hospital Infantil de Pittsburgh da UPMC e da Escola de Medicina da Universidade de Pittsburgh mostraram como um vírus comum vírus sequestra a proteína de uma célula hospedeira para ajudar a montar novos vírus antes que eles sejam liberados. As descobertas aumentam a nossa compreensão de como os vírus se reproduzem no corpo e podem levar a novas terapêuticas.
Embora a maioria das pesquisas sobre infecções virais tenha se concentrado nos mecanismos que os vírus usam para entrar nas células, pouco se sabe sobre as etapas finais da infecção. As novas descobertas foram identificadas no reovírus, um vírus comum que normalmente é inofensivo, mas que recentemente foi implicado como uma causa potencial da doença celíaca.
“Nosso trabalho fornece evidências convincentes de que os reovírus, e talvez vírus adicionais distantemente relacionados, requerem uma máquina especializada de dobramento de proteínas expressa em células para se replicarem”, disse Terence Dermody, MD, presidente do Departamento de Pediatria da Escola de Medicina de Pitt, médico- diretor-chefe e científico do Hospital Infantil e autor sênior do estudo. “Esta é uma descoberta bastante notável porque os vírus são em grande parte feitos de complexos blocos de construção de proteínas e sabemos pouco sobre como esses blocos são montados.”
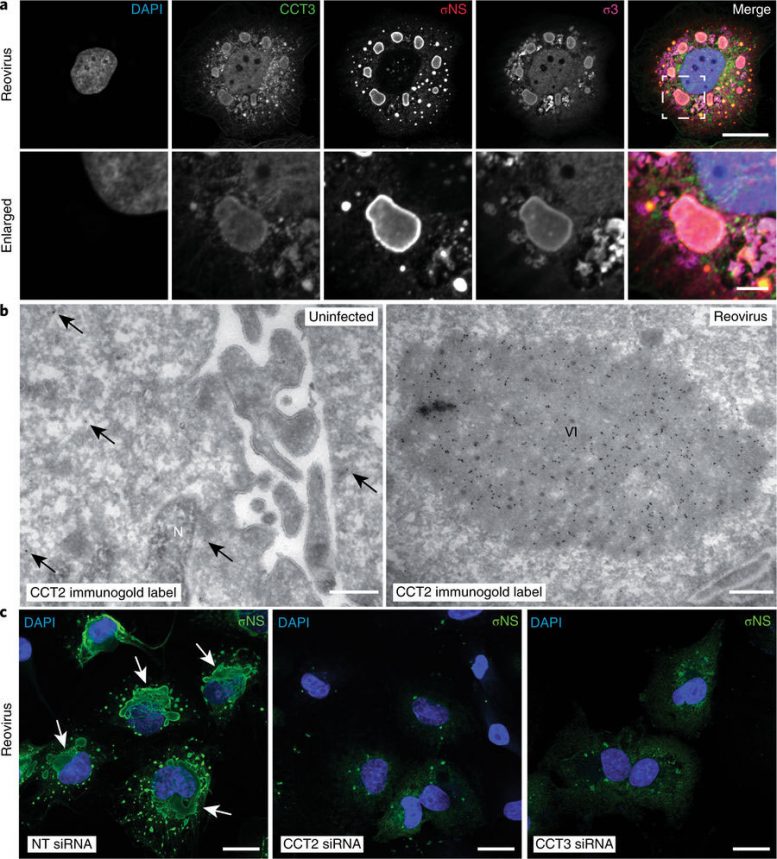
Figura 3: TRiC é redistribuído para inclusões virais e é necessário para a morfogênese da inclusão. a, Imagens de imunofluorescência confocal de HBMECs infectados com reovírus T3D (MOI de 100 PFU por célula, 24 horas após a infecção) corados com DAPI (azul) e anticorpos específicos para CCT3 (verde), σNS (vermelho) e σ3 (magenta). As inclusões virais são identificáveis pela coloração σNS. As imagens ampliadas correspondem à região indicada pela caixa branca tracejada na imagem mesclada. Barras de escala, 20 μm e 4 μm em imagens em tamanho real e ampliadas, respectivamente. b, Criosecções Tokuyasu de HBMECs não infectados ou infectados com reovírus T1L (MOI de 1 PFU por célula, 20 horas após a infecção) imunogold marcado para CCT2. Barras de escala, 500 nm. As setas indicam partículas de ouro observadas em células não infectadas. VI, inclusão viral; N, núcleo. c, imagens de imunofluorescência confocal de HBMECs transfectados com siRNAs específicos da subunidade NT ou TRiC, infectados com reovírus T1L (MOI de 100 PFU por célula, 24 horas após a infecção) e corados com DAPI (azul) e um anti-soro específico para σNS (verde). Barras de escala, 20 μm. Inclusões grandes e globulares são marcadas por setas brancas. As imagens são representativas de três experimentos independentes conduzidos com resultados semelhantes. Jonathan J. Knowlton, et al., Nature Microbiology (2018) doi:10.1038/s41564-018-0122-x
Dobrar proteínas da maneira correta é crucial para sua função. “Pense em uma proteína desdobrada como uma folha de papel comum: pouco notável por si só, mas capaz de realizar funções sofisticadas quando dobrada de uma determinada maneira, como em um avião. Da mesma forma, as proteínas precisam se dobrar em formas específicas para funcionarem corretamente”, disse Jonathan Knowlton, primeiro autor do estudo e pesquisador do laboratório de Dermody.
Ao examinar um grande número de proteínas em células cultivadas em laboratório, os investigadores descobriram que o reovírus sequestra uma proteína acompanhante – uma máquina que dobra outras proteínas – chamada TRiC, que está presente em todas as células. No caso do reovírus, o TRiC dobra um componente importante do invólucro proteico que forma a camada externa do vírus, necessária para que ele saia da célula e infecte outras células saudáveis. Quando o TRiC é interrompido, a camada externa não pode se formar e o ciclo de replicação viral é interrompido.
Este estudo lança luz sobre o processo pouco compreendido pelo qual as proteínas virais se dobram e se reúnem para formar novas partículas. Os pesquisadores estão agora estudando se outros vírus usam essa via para se reproduzir, identificando as etapas exatas do processo de dobramento possibilitado pelo TRiC e procurando moléculas que inibam o processo, que poderiam ser desenvolvidas como terapias.
Além disso, esta pesquisa contribui para a compreensão de como funciona o mecanismo de enovelamento de proteínas dentro das células e pode explicar as manifestações de doenças de enovelamento incorreto de proteínas, como Alzheimer e Huntington.
Referência: “A chaperonina TRiC controla a replicação do reovírus através do dobramento do capsídeo externo” por Jonathan J. Knowlton, Isabel Fernández de Castro, Alison W. Ashbrook, Daniel R. Gestaut, Paula F. Zamora, Joshua A. Bauer, J. Craig Forrest , Judith Frydman, Cristina Risco e Terence S. Dermody, 12 de março de 2018, Microbiologia da Natureza.
DOI: 10.1038/s41564-018-0122-x
