Por favor, avalie esta postagem
Protegendo o microbioma intestinal humano com biologia sintética
Um bioterapêutico vivo projetado protege o microbioma intestinal contra consequências indesejadas de terapias com antibióticos e pode ser desenvolvido como uma co-terapia simples e eficaz.
Muitos de nós experimentamos um desequilíbrio intestinal como resultado de uma terapia antibiótica inevitável. Os antibióticos não só matam as bactérias patogénicas que causam uma infecção, como também causam estragos indiscriminadamente nos biliões de bactérias “boas” que constituem a microbiota humana. Conhecida como “disbiose”, esta alteração da nossa composição microbiana intestinal provoca diarreia desconfortável em até 35% dos pacientes a curto prazo, e pode levar meses para ser resolvida, muitas vezes com a ajuda de correções dietéticas e suplementos. Em alguns pacientes, a microbiota pode até ficar permanentemente perturbada, o que se torna um sério fator de risco para uma série de doenças autoimunes, metabólicas e neurológicas.
Isso ocorre porque desenvolvemos uma relação mutuamente altamente benéfica com os micróbios do nosso microbioma intestinal e, de fato, formamos um “superorganismo” com eles no qual nós, como “hospedeiros”, moldamos a composição do nosso microbioma com o nosso ambiente intestinal, bem como a nossa alimentação e outros hábitos. Por sua vez, os nossos “convidados” microbianos produzem diversos compostos que afetam profundamente a forma como digerimos os alimentos, utilizamos a energia e apoiamos a nossa imunidade, entre muitas outras funções. Apesar da importância do nosso microbioma para a nossa saúde, até agora não houve solução mágica para prevenir a disbiose induzida por antibióticos.
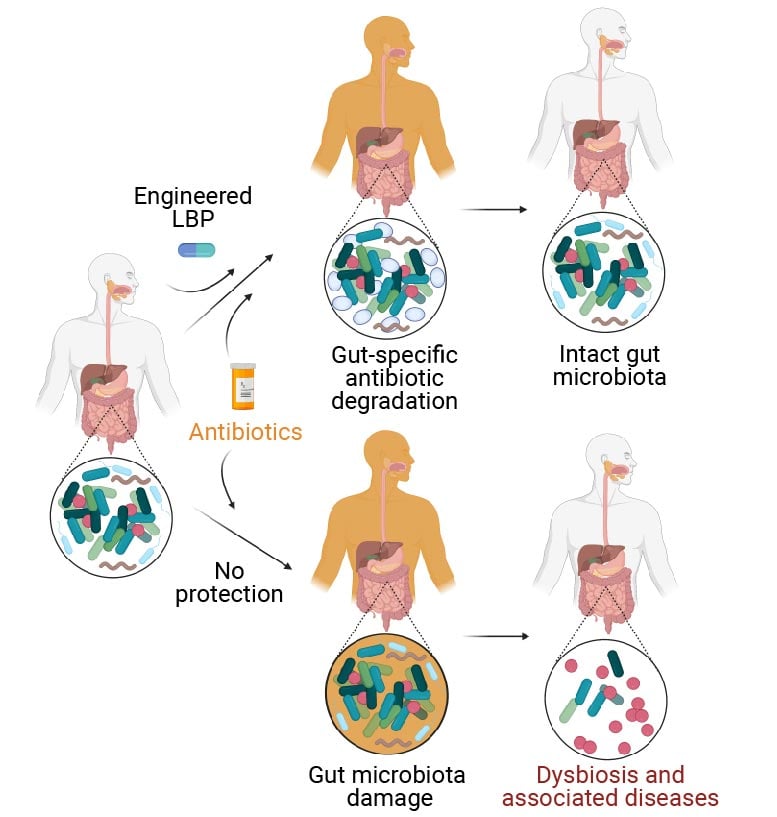
Pacientes humanos tratados com antibióticos sofrem danos ao microbioma intestinal (ramo inferior), o que faz com que sua composição normal seja desequilibrada. Conhecido como “disbiose”, esse desequilíbrio é um fator de risco para uma série de doenças autoimunes, metabólicas e neurológicas. Como solução, tratar pacientes que recebem um antibiótico simultaneamente com um produto bioterapêutico vivo projetado (eLBP, ramo superior) desenvolvido no Wyss Institute e no MIT, que degrada os antibióticos no intestino, evita os efeitos destrutivos dos antibióticos no microbioma intestinal. Como o eLBP não altera a concentração de antibióticos no sangue, eles ainda atingem infecções em todas as outras partes do corpo. Crédito: Wyss Institute da Universidade de Harvard
Agora, uma equipe de pesquisa do Instituto Wyss de Engenharia Biologicamente Inspirada da Universidade de Harvard e do Instituto de Tecnologia de Massachusetts (MIT), usando uma abordagem de biologia sintética, desenvolveu um produto bioterapêutico vivo projetado (eLBP) que, quando administrado junto com antibióticos comumente usados, conhecidos como ß-lactâmicos (que incluem o conhecido antibiótico penicilina), protege o microbioma intestinal da disbiose. O estudo é publicado em Engenharia Biomédica da Natureza.
“Ao projetar o eLBP, aproveitamos o kit de biologia sintética que avançamos nas últimas duas décadas e permitimos Lactococcus lactis, um micróbio seguro para uso, para secretar uma enzima ß-lactamase que degrada altruisticamente os ß-lactâmicos no ambiente da bactéria”, disse James Collins, Ph.D., membro do corpo docente do Wyss Core e líder da Plataforma de Dispositivos Celulares Vivos do Instituto. , que liderou o estudo. “A enzima torna-se essencialmente um 'bem comum' que não pode conferir uma vantagem seletiva à bactéria produtora ou ser facilmente transferida para outras bactérias, minimizando o risco e maximizando os benefícios clínicos da nossa abordagem.” Collins também é Professor Termeer de Engenharia Médica e Ciência no MIT. Em 2018, sua equipe utilizou L. lactis para desenvolver uma intervenção probiótica projetada para detectar e tratar infecções de cólera.
A proteção contra antibióticos entra em vigor
Normalmente, as enzimas ß-lactamases são codificadas por um único gene que pode ser transmitido entre bactérias por meio de um processo denominado transferência horizontal de genes, e as próprias enzimas residem dentro da parede celular ou dos invólucros da membrana da bactéria. Isto não só torna a estirpe bacteriana produtora resistente a certos antibióticos que atacam estes invólucros exteriores, mas também permite que a sua resistência se espalhe a outras bactérias na população microbiana intestinal. “Para proteger contra o desenvolvimento e propagação da resistência aos antibióticos, projetamos várias unidades de controle no sistema de expressão da ß-lactamase. Essencialmente, dividimos um gene específico que codifica a ß-lactamase, distribuímos as duas metades geneticamente desvinculadas em diferentes partes do organismo da bactéria. ADNe os projetou para que fossem secretados para longe da célula produtora e se ligassem uns aos outros com alta afinidade para remontar uma enzima funcional em seu ambiente externo”, disse o primeiro autor Andrés Cubillos-Ruiz, Ph.D., que liderou o projeto no grupo de Collins.
Cubillos-Ruiz e seus colegas da equipe de Collins mostraram então que, quando aplicaram sua intervenção eLBP em ratos que receberam o antibiótico ampicilina como tratamento oral, isso de fato minimizou a disbiose no intestino de cada animal. Ao sequenciar uma parte do genoma bacteriano conhecida como 16S rDNA, que fornece um código postal genético para todas as bactérias espécies e famílias, descobriram que o eLBP amorteceu significativamente o colapso das populações microbianas e permitiu-lhes recuperar totalmente a sua diversidade e composição originais três dias após o tratamento com antibióticos. Os ratos tratados com ampicilina que não foram protegidos pelo eLPB sofreram uma perda muito maior da sua diversidade microbiana, que não conseguiram recuperar durante todo o período da experiência.
“É importante ressaltar que durante sua permanência transitória no trato digestivo, o eLBP protegeu o microbioma sem alterar a concentração de ampicilina circulante no sangue, o que é importante porque o antibiótico ainda precisa atingir infecções em todas as outras partes do corpo para fazer seu trabalho”, disse Cubillos-Ruiz. “O eLBP também reduziu o enriquecimento de vários genes de resistência a antibióticos na comunidade microbiana, o que normalmente acontece sob a pressão seletiva dos antibióticos.” O microbioma intestinal contém um conjunto natural de bactérias com genes, incluindo genes de ß-lactamases, que induzem resistência a antibióticos através de diferentes mecanismos – incluindo resistência mesmo a antibióticos não relacionados. A cada tratamento com antibióticos, o seu número aumenta e também contribui para a propagação da resistência aos antibióticos através da transferência horizontal de genes.
“Agora estamos nos concentrando em levar essas terapias vivas aos pacientes e finalizando o desenho de um ensaio clínico eficaz, curto e barato. Acreditamos também que a nossa abordagem geral do eLBP pode ser estendida a uma plataforma terapêutica que poderia ser aplicada não apenas a outros antibióticos, mas também para tratar doenças onde a disbiose intestinal está no centro.”
– Andrés Cubillos-Ruiz
Manter o controle sobre bactérias oportunistas
Finalmente, a equipe abordou uma consequência comum da disbiose: a tomada hostil do território intestinal desocupado por bactérias problemáticas como Clostridioides difficile. Estas “bactérias oportunistas” vivem em números mais baixos nos intestinos de muitas pessoas e, quando têm a oportunidade de se multiplicarem incontrolavelmente, provocam inflamação, diarreia e podem contribuir para o desenvolvimento de doenças inflamatórias intestinais. A equipe modelou um ser humano completo C. difficile infecção infectando camundongos tratados com ampicilina com esporos de C. difficile. O eLBP preveniu com sucesso a colonização intestinal com C. difficileem contraste com um normal não modificado L. lactis cepa que não produz a enzima ß-lactamase dividida.
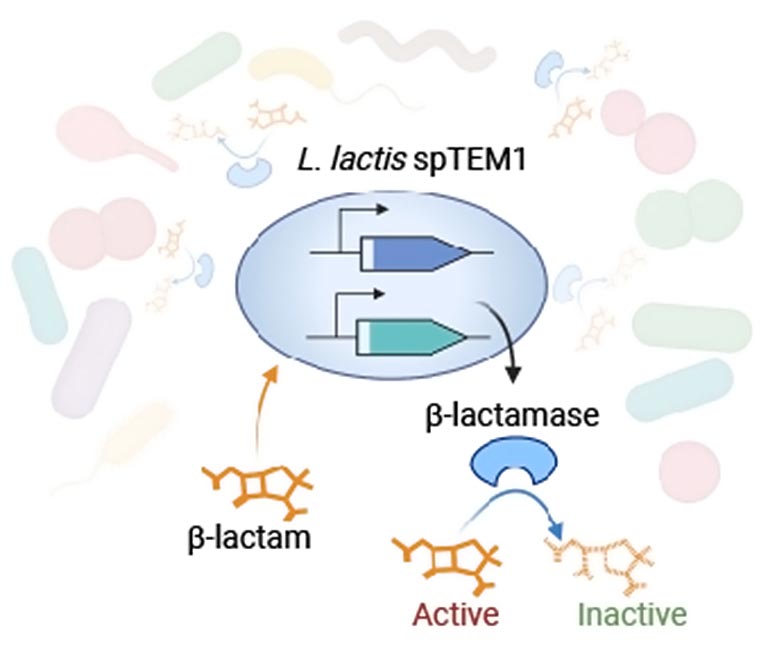
Usando ferramentas de biologia sintética, a equipe projetou o micróbio Lactococcus lactis, seguro para uso, para secretar uma enzima β-lactamase chamada TEM1, que degrada altruisticamente os β-lactâmicos no ambiente da bactéria. Para tornar sua abordagem segura, evitando que a cepa produtora tenha uma vantagem seletiva sobre outras cepas no intestino e espalhando um gene TEM1 totalmente funcional através da comunidade microbiana intestinal por meio de “transferência horizontal de genes”, eles dividiram o gene que codifica a enzima e distribuíram ambas as metades para diferentes partes do DNA da bactéria. Traduzidos em proteínas e secretados no ambiente da bactéria, eles remontam uma enzima β-lactamase funcional que inativa os antibióticos β-lactâmicos. Crédito: Wyss Institute da Universidade de Harvard
“Este é um dos exemplos mais fortes de uma terapia celular viva projetada para lidar com um problema clínico urgente que vem da academia até agora”, disse Collins.
“Agora estamos nos concentrando em levar essas terapias vivas aos pacientes e finalizando o desenho de um ensaio clínico eficaz, curto e barato”, disse Cubillos-Ruiz, acrescentando que: “Também acreditamos que nossa abordagem geral do eLBP pode ser estendida para uma plataforma terapêutica que poderia ser aplicada não apenas a outros antibióticos, mas também para tratar doenças onde a disbiose intestinal está no centro.”
Este dispositivo terapêutico celular vivo, elegantemente projetado e altamente eficaz, pode tornar-se um verdadeiro divisor de águas no tratamento de doenças infecciosas, ajudando a manter um microbioma saudável em pacientes tratados com antibióticos e, talvez igualmente importante a longo prazo, prevenindo o problema crescente da resistência aos antibióticos, que é um problema crescente em todo o mundo”, disse o Diretor Fundador da Wyss, Donald Ingber, MD, Ph.D., que também é o Judah Folkman Professor de Biologia Vascular no HMS e no Boston Children's Hospital, e Hansjörg Professor de Engenharia Bioinspirada na Escola de Engenharia e Ciências Aplicadas John A. Paulson de Harvard.
Referência: “Um bioterapêutico vivo projetado para a prevenção da disbiose induzida por antibióticos” por Andrés Cubillos-Ruiz, Miguel A. Alcantar, Nina M. Donghia, Pablo Cárdenas, Julian Avila-Pacheco e James J. Collins, 11 de abril de 2022, Engenharia Biomédica da Natureza.
DOI: 10.1038/s41551-022-00871-9
Outros autores do estudo são Miguel Alcantar e Nina Donghia do grupo de Collins, Pablo Cárdenas do Departamento de Engenharia Biológica do MIT e Julian Avila-Pacheco do Broad Institute. O estudo foi financiado pelo Wyss Institute da Universidade de Harvard, com uma bolsa da Defense Threat Reduction Agency (#HDTRA1-14-1-0006) e pelo Paul G. Allen Frontiers Group.
