Por favor, avalie esta postagem
O Chip Alvéolo Humano contém canais laterais ocos que permitem a aplicação de sucção aos chips, aplicando tensão cíclica que imita os movimentos da respiração humana normal (esquerda). Uma membrana permeável separa as células alevolus humanas no canal superior das células dos vasos sanguíneos humanos no canal inferior, permitindo-lhes trocar sinais moleculares (direita). Crédito: Wyss Institute da Universidade de Harvard
Human Lung Chip revela os efeitos dos movimentos respiratórios nas respostas imunológicas pulmonares e leva ao reaproveitamento de possíveis terapêuticas para doenças respiratórias, incluindo COVID 19.
A pessoa média respira mais de 600 milhões de vezes ao longo da vida. Cada respiração alonga os tecidos dos pulmões a cada inspiração e os relaxa a cada expiração. Sabe-se que os meros movimentos respiratórios influenciam as funções vitais dos pulmões, incluindo o seu desenvolvimento em bebés, a produção de fluido que melhora a troca de ar nas suas superfícies internas e a manutenção da estrutura saudável dos tecidos. Agora, uma nova investigação do Instituto Wyss da Universidade de Harvard revelou que este padrão constante de alongamento e relaxamento faz ainda mais – gera respostas imunitárias contra vírus invasores.
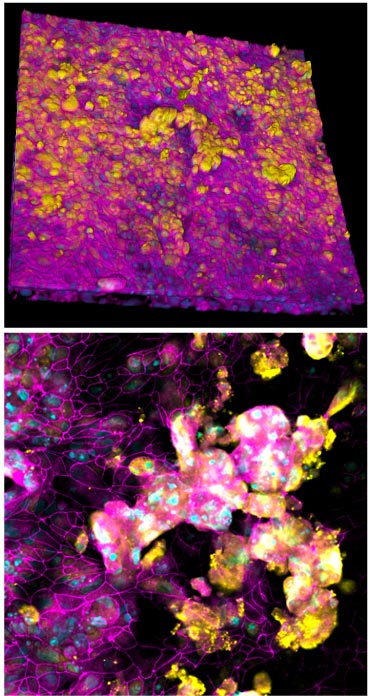
Estas micrografias de imunofluorescência (em diferentes ampliações) mostram a estrutura celular 3D que se desenvolve dentro do canal alveolar e imita a microestrutura dos alvéolos humanos. Crédito: Wyss Institute da Universidade de Harvard
Usando um chip de pulmão humano que replica as estruturas e funções do saco aéreo pulmonar, ou “alvéolo”, a equipe de pesquisa descobriu que a aplicação de forças mecânicas que imitam os movimentos respiratórios suprime a gripe. vírus replicação ativando respostas imunes inatas protetoras. Eles também identificaram vários medicamentos que reduziram a produção de citocinas inflamatórias em Alveolus Chips infectados, o que poderia ser útil no tratamento da inflamação excessiva no pulmão. Com base nestes estudos, um desses medicamentos foi licenciado à Cantex Pharmaceuticals para o tratamento da COVID-19 e outras doenças inflamatórias pulmonares. Os dados da pesquisa foram recentemente incluídos no pedido de Novo Medicamento Investigacional (IND) da empresa ao FDA para iniciar um ensaio clínico de Fase 2 para COVID-19.
“Esta pesquisa demonstra a importância dos movimentos respiratórios para a função pulmonar humana, incluindo respostas imunológicas a infecções, e mostra que nosso Chip de Alvéolo Humano pode ser usado para modelar essas respostas nas porções profundas do pulmão, onde as infecções são frequentemente mais graves e levam à hospitalização e morte”, disse o coautor Haiqing Bai, Ph.D., bolsista de desenvolvimento de tecnologia Wyss no Instituto. “Este modelo também pode ser usado para testes pré-clínicos de medicamentos para garantir que os medicamentos candidatos realmente reduzam a infecção e a inflamação no tecido pulmonar humano funcional.” Os resultados são publicados hoje (8 de abril de 2022) em Comunicações da Natureza.
Criando uma gripe em um chip
Como as fases iniciais da pandemia de COVID-19 deixaram dolorosamente claro, o pulmão é um órgão vulnerável onde a inflamação em resposta à infecção pode gerar uma “tempestade de citocinas” que pode ter consequências mortais. No entanto, os pulmões também são muito complexos e é difícil replicar as suas características únicas em laboratório. Esta complexidade tem dificultado a compreensão da ciência sobre como os pulmões funcionam a nível celular e tecidual, tanto em estados saudáveis como doentes.
O Instituto Wyss Chips de órgãos humanos foram desenvolvidos para resolver este problema e demonstraram replicar fielmente as funções de muitos órgãos humanos diferentes no laboratório, incluindo o pulmão. No âmbito de projectos financiados pelo NIH e DARPA desde 2017, os pesquisadores da Wyss têm trabalhado na replicação de várias doenças nas vias aéreas pulmonares e nos chips de alvéolos para estudar como os tecidos pulmonares reagem a vírus respiratórios com potencial pandêmico e testar possíveis tratamentos.
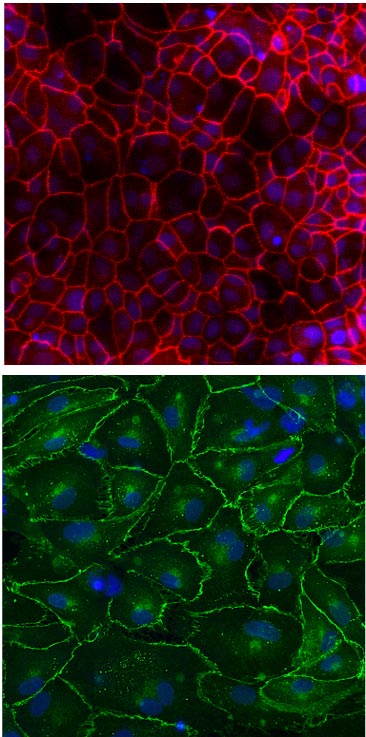
Tanto no canal alveolar superior (parte superior) quanto no canal inferior dos vasos sanguíneos (parte inferior) dos Alveolus Chips, as células formaram tecidos intactos mantidos juntos por proteínas entre as células chamadas ZO1 e VE-caderina, que são coradas em vermelho e verde, respectivamente. Crédito: Wyss Institute da Universidade de Harvard
Durante seu doutorado. treinamento, Bai estudou doenças que afetam os pequenos sacos de ar nas profundezas dos pulmões, onde o oxigênio é rapidamente trocado por dióxido de carbono. Essa fundação o preparou para enfrentar o desafio de recriar uma infecção de gripe em um Alveolus Chip para que a equipe pudesse estudar como esses espaços pulmonares profundos montam respostas imunológicas contra invasores virais.
Bai e sua equipe primeiro alinharam os dois canais microfluídicos paralelos de um Chip de Órgão com diferentes tipos de células humanas vivas – células pulmonares alveolares no canal superior e células dos vasos sanguíneos pulmonares no canal inferior – para recriar a interface entre os sacos aéreos humanos e seus capilares transportadores de sangue. Para imitar as condições que os alvéolos experimentam no pulmão humano, o canal revestido por células alveolares foi preenchido com ar enquanto o canal do vaso sanguíneo foi perfundido com um meio de cultura fluido contendo nutrientes que normalmente são fornecidos. através da o sangue. Os canais foram separados por uma membrana porosa que permitiu que as moléculas fluíssem entre eles.
Estudos anteriores do Wyss Institute estabeleceram que a aplicação de alongamento cíclico aos Alveolus Chips para imitar os movimentos respiratórios produz respostas biológicas que imitam aquelas observadas na Vivo. Isto é conseguido aplicando sucção às câmaras laterais ocas adjacentes aos canais fluídicos revestidos de células para esticar e relaxar ritmicamente os tecidos pulmonares em 5%, que é o que os pulmões humanos normalmente experimentam a cada respiração.
Quando a equipe infectou esses Alveolus Chips “respiratórios” com influenza H3N2, introduzindo o vírus no canal de ar, eles observaram o desenvolvimento de várias características conhecidas da infecção por influenza, incluindo a quebra de junções entre as células, um aumento de 25% na morte celular, e o início de programas de reparo celular. A infecção também levou a níveis muito mais elevados de múltiplas citocinas inflamatórias no canal dos vasos sanguíneos, incluindo o interferon tipo III (IFN-III), uma defesa natural contra infecções virais que também é ativada em na Vivo estudos de infecção por gripe.
Além disso, as células dos vasos sanguíneos dos chips infectados expressaram níveis mais elevados de moléculas de adesão, o que permitiu que as células imunológicas, incluindo células B, células T e monócitos no meio de perfusão, se ligassem às paredes dos vasos sanguíneos para ajudar a combater a infecção. Esses resultados confirmaram que o Alveolus Chip estava montando uma resposta imunológica contra o H3N2 que recapitulou o que acontece no pulmão de pacientes humanos infectados pelo vírus da gripe.
Concentre-se em sua respiração
A equipe então realizou o mesmo experimento sem movimentos mecânicos de respiração. Para sua surpresa, os chips expostos aos movimentos respiratórios tinham 50% menos mRNA viral nos canais alveolares e uma redução significativa nos níveis de citocinas inflamatórias em comparação com os chips estáticos. A análise genética revelou que a cepa mecânica ativou vias moleculares relacionadas à defesa imunológica e a múltiplos genes antivirais, e essas ativações foram revertidas quando o alongamento cíclico foi interrompido.

Haiqing Bai – Co-autor, Haiqing Bai, Ph.D., traz sua experiência no estudo de doenças que afetam os sacos de ar do pulmão humano, ou “alvéolos”, para sua pesquisa sobre chips de órgãos no Instituto Wyss. Crédito: Wyss Institute da Universidade de Harvard
“Esta foi a nossa descoberta mais inesperada – que o estresse mecânico por si só pode gerar uma resposta imune inata no pulmão”, disse o co-autor Longlong Si, Ph.D., ex-bolsista de desenvolvimento de tecnologia da Wyss que agora é professor na Universidade de Shenzhen. Instituto de Tecnologia Avançada da China.
Sabendo que por vezes os pulmões sofrem uma tensão superior a 5%, como na doença pulmonar obstrutiva crónica (DPOC) ou quando os pacientes são colocados em ventiladores mecânicos, os cientistas aumentaram a tensão para 10% para ver o que aconteceria. A cepa mais alta causou um aumento nos genes e processos da resposta imune inata, incluindo várias citocinas inflamatórias.
“Como o nível de tensão mais elevado resultou numa maior produção de citocinas, isso pode explicar porque é que os pacientes com doenças pulmonares como a DPOC sofrem de inflamação crónica, e porque é que os pacientes que são colocados em ventiladores de alto volume por vezes sofrem lesões pulmonares induzidas pelo ventilador”, explicou Si.
Do chip aos ensaios clínicos
Os cientistas então deram um passo adiante, comparando o ARN moléculas presentes nas células dentro de Chips de Alvéolo tensos versus estáticos para ver se eles conseguiam identificar como os movimentos respiratórios estavam gerando uma resposta imunológica. Eles identificaram uma proteína de ligação ao cálcio, chamada S100A7, que não foi detectada em chips estáticos, mas altamente expressa em chips tensos, sugerindo que a sua produção foi induzida por estiramento mecânico. Eles também descobriram que o aumento da expressão de S100A7 regulou positivamente muitos outros genes envolvidos na resposta imune inata, incluindo múltiplas citocinas inflamatórias.
S100A7 é uma das várias moléculas relacionadas conhecidas por se ligar a uma proteína nas membranas das células chamada receptor para produtos finais de glicação avançada (RAGE). RAGE é mais altamente expresso no pulmão do que em qualquer outro órgão do corpo humano e tem sido implicado como um importante mediador inflamatório em diversas doenças pulmonares. A droga azeliragon é um conhecido inibidor de RAGE, então os cientistas perfundiram azeliragon através do canal dos vasos sanguíneos dos Alveolus Chips tensos por 48 horas e depois infectaram os chips com o vírus H3N2. Este pré-tratamento evitou a resposta semelhante à tempestade de citocinas que observaram em chips não tratados.
Com base neste resultado promissor, a equipe infectou os Alveolus Chips com H3N2 e administrou azeliragon em sua dose terapêutica duas horas após a infecção. Esta abordagem bloqueou significativamente a produção de citocinas inflamatórias – um efeito que foi ainda melhorado quando adicionaram o medicamento antiviral molnupiravir (que foi recentemente aprovado para pacientes com COVID-19) ao regime de tratamento.
Esses resultados chamaram a atenção da Cantex Pharmaceuticals, que detém os direitos de patente do azeliragon e estava interessada em usá-lo no tratamento de doenças inflamatórias. Com base em parte no trabalho da equipe Wyss em Alveolus Chips, a Cantex licenciou o azeliragon para o tratamento de COVID-19 e outras doenças pulmonares inflamatórias no início de 2022. Dado o excelente histórico de segurança do medicamento em ensaios clínicos anteriores de Fase 3, a empresa solicitou o FDA aprovação para iniciar um ensaio de Fase 2 em pacientes com COVID-19 e planeja seguir com ensaios adicionais de Fase 2 para outras doenças, incluindo DPOC e asma resistente a esteróides.
“Graças ao excelente trabalho dos cientistas do Instituto Wyss, temos agora provas convincentes de que o azeliragon pode ter o potencial de prevenir a doença grave da COVID-19 na forma de um comprimido de toma única diária. Estamos entusiasmados por ter a oportunidade de realizar ensaios clínicos de azeliragon para esta doença, buscando levar esta terapia inovadora aos pacientes para prevenir a inflamação potencialmente fatal que é uma das principais causas de hospitalização e morte”, disse Stephen Marcus, MD, CEO da Cantex.
Embora o azeliragon seja um medicamento anti-inflamatório promissor, os cientistas alertam que são necessários mais estudos para determinar um regime de tratamento seguro e eficaz em humanos. O RAGE é um elemento vital no início da inflamação benéfica contra patógenos nos estágios iniciais de uma infecção, e inibi-lo muito cedo pode impedir que o paciente desenvolva uma resposta imunológica suficiente.
Dadas as muitas vantagens do Alveolus Chip em relação aos modelos pré-clínicos tradicionais, a equipe de Wyss está explorando a incorporação de tipos de células adicionais, como macrófagos, nos chips para aumentar sua complexidade e modelar mais processos biológicos, como a imunidade adaptativa. Eles também estão usando o modelo existente para estudar a eficácia de novos compostos, medicamentos e produtos biológicos (como terapias de mRNA) contra a gripe, SARS-CoV-2e outras doenças.
“Este importante artigo levou à descoberta da promessa dos inibidores RAGE para o tratamento de doenças inflamatórias pulmonares, que foi a base para a recente licença do azeliragon para a Cantex e seu movimento em direção a ensaios clínicos em humanos para a COVID-19. Estou extremamente orgulhoso desta equipe e da rapidez com que esta descoberta científica foi traduzida em comercialização que, esperançosamente, levará a um tratamento que salvará vidas de pacientes. É disso que se trata o Wyss Institute”, disse o autor sênior Donald Ingber, MD, Ph.D., que é o Diretor Fundador do Wyss Institute, bem como o Judah Folkman Professor de Biologia Vascular na Harvard Medical School (HMS) e no Boston Children's Hospital, e Hansjörg Wyss Professor de Engenharia Bioinspirada na Harvard John A. Paulson School of Engineering and Applied Sciences.
Referência: “Controle mecânico das respostas imunes inatas contra infecção viral revelada em um chip de alvéolo pulmonar humano” por Haiqing Bai, Longlong Si, Amanda Jiang, Chaitra Belgur, Yunhao Zhai, Roberto Plebani, Crystal Yuri Oh, Melissa Rodas, Aditya Patil, Atiq Nurani, Sarah E. Gilpin, Rani K. Powers, Girija Goyal, Rachelle Prantil-Baun e Donald E. Ingber, 8 de abril de 2022, Comunicações da Natureza.
DOI: 10.1038/s41467-022-29562-4
Autores adicionais do estudo incluem Amanda Jiang, Chaitra Belgur, MS, Yunhao Zhai, Ph.D., Melissa Rodas e Aditya Patil e Girija Goyal, Ph.D. do Wyss Institute, e ex-membros do Wyss Institute Roberto Plebani, Ph.D., Crystal Oh, Atiq Nurani, MS, Sarah Gilpin, Ph.D., Rani Powers, Ph.D. e Rachelle Prantil-Baun, Ph.D.
Esta pesquisa foi apoiada pelo Instituto Wyss de Engenharia Biologicamente Inspirada da Universidade de Harvard, pela Agência de Projetos de Pesquisa Avançada de Defesa dos EUA (DARPA) sob o Acordo Cooperativo HR0011-20-2-0040, e o Instituto Nacional de Saúde sob subvenções UG3-HL-141797 e UH3-HL-141797.
