Por favor, avalie esta postagem
Superfície de uma cultura mucosoide infectada por Helicobater feita de células epiteliais normais do estômago humano (vermelho: Helicobacter pylori, azul: núcleos, verde: membranas celulares). © MPI f. Biologia da Infecção
A bactéria gástrica H. pylori coloniza o estômago de cerca de metade da população humana e pode levar ao desenvolvimento de cancro gástrico. Geralmente é adquirida na infância e persiste por toda a vida, apesar de forte reação inflamatória de defesa na mucosa gástrica. Essa inflamação normalmente é benéfica, pois mata os patógenos invasores e depois é resolvida. No caso do H. pylori, porém, a inflamação nunca consegue eliminar o invasor e, em vez disso, persiste durante décadas – o que é uma força motriz no desenvolvimento de úlceras e cancro. Embora muitas bactérias persistentes dependam da prevenção da detecção imunológica, a persistência no meio de uma inflamação aguda é um feito altamente incomum para um patógeno, e até agora não está claro como o Helicobacter é capaz de fazer isso.
Agora, investigadores do Instituto Max Planck de Biologia de Infecções, em Berlim, descobriram que, ao extrair o colesterol das membranas das células hospedeiras, o H. pylori decompõe um componente vital necessário para montar os receptores dos interferões. Estas citocinas são moléculas sinalizadoras essenciais para convocar o sistema imunitário adaptativo para a mucosa infectada – e a sua ausência gera um nicho onde as bactérias podem sobreviver enquanto a inflamação continua inabalável na área circundante.
Embora a gastrite e a úlcera gástrica costumavam ser atribuídas ao estresse e a fatores dietéticos, foi descoberto na década de 1980 que o verdadeiro culpado é a infecção por uma bactéria, H. pylori. Este patógeno é agora classificado como cancerígeno tipo I pela OMS, pois é o principal fator de risco para o desenvolvimento de carcinoma gástrico. As tentativas de desenvolver uma vacina contra o H. pylori não tiveram sucesso e os novos resultados fornecem a primeira explicação potencial para estes fracassos: o H. pylori bloqueia o sinal que permitiria às células infectadas solicitar ajuda do sistema imunitário.
Impulsionados pelo interesse em compreender os mecanismos pelos quais as infecções bacterianas podem dar origem ao cancro, o laboratório de Thomas F. Meyer já descobriu há mais de uma década que o H. pylori expressa uma enzima chamada colesterol-α-glucosiltransferase para extrair o colesterol de que necessita. a partir de células hospedeiras. Sem esta enzima, as bactérias não conseguem infectar os ratos. Na época, o grupo também observou que o excesso de colesterol na dieta dos ratos aumentava a eliminação do patógeno, mas exacerbava a inflamação. Exatamente como a capacidade de extrair colesterol estava ligada à evasão imunológica ainda não estava claro na época.
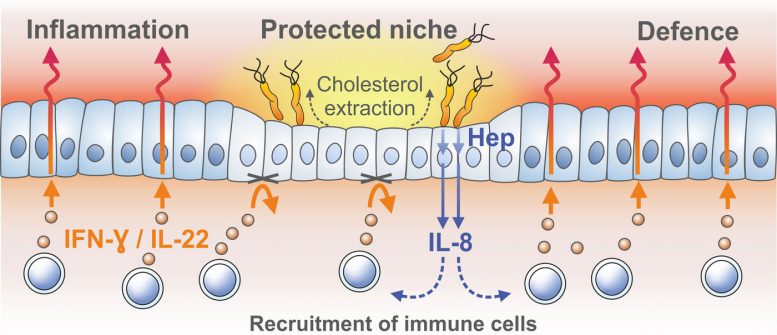
A extração de colesterol das células hospedeiras permite que a bactéria Helicobacter gere nichos protegidos de células nos quais as vias normais de sinalização para o recrutamento de células imunológicas são bloqueadas. © MPI f. Biologia da Infecção
Agora, novas tecnologias para o cultivo in vitro de células primárias do estômago têm sido fundamentais para resolver este enigma. O laboratório de Meyer conseguiu reconstituir o epitélio da mucosa do estômago, produzindo os chamados “mucosóides”, nos quais as células gástricas crescem como monocamadas com uma superfície externa e outra interna e até produzem o muco que reveste e protege o estômago. Como resultado, os “mini-órgãos” infectados poderiam ser mantidos vivos durante meses.
O colesterol é necessário para a formação de jangadas lipídicas
As células epiteliais gástricas infectadas normalmente convocam células do sistema imunológico e geram fatores antimicrobianos que matam as bactérias. Esta resposta depende de um fator crucial de sinalização imunológica produzido pelas células epiteliais: o interferon-γ. Usando o modelo mucosoide, o grupo descobriu que as bactérias sobrevivem como pequenas microcolônias no topo das células. Isto resultou na ausência das chamadas “jangadas lipídicas” nas membranas celulares, que são necessárias para a montagem dos complexos receptores de interferon. Sem estes, as células hospedeiras simplesmente não respondiam ao interferon-γ. As jangadas lipídicas são feitas de colesterol e sua destruição é mediada pela colesterol-α-glicosiltransferase da bactéria.
“Mostrar como o H. pylori persiste no meio de uma inflamação aguda explica toda uma série de observações que intrigaram os pesquisadores durante décadas e nos fizeram pensar no cenário da infecção sob uma luz totalmente nova”, diz Pau Morey, primeiro autor do estudar. Francesco Boccellato, que desenvolveu o novo modelo in vitro, acrescenta: “os mucosóides permitem a investigação de infecções estáveis e de longo prazo – e serão uma ferramenta inestimável para examinar os mecanismos subjacentes às infecções das mucosas, à defesa da mucosa e ao surgimento do cancro”.
Referências:
- “Helicobacter Pylori esgota o colesterol nas glândulas gástricas para prevenir a sinalização do interferon gama e escapar da resposta inflamatória” por Pau Morey, Lennart Pfannkuch, Ervinna Pang, Francesco Boccellato, Michael Sigal, Aki Imai-Matsushima, Victoria Dyer, Manuel Koch, Hans-Joachim Mollenkopf , Philipp Schlaermann e Thomas F. Meyer, 19 de dezembro de 2017, Gastroenterologia.
DOI: 10.1053/j.gastro.2017.12.008 - “Monocamadas epiteliais polarizadas da mucosa gástrica revelam insights sobre a homeostase da mucosa e a defesa contra infecções” por Francesco Boccellato, Sarah Woelffling, Aki Imai-Matsushima, Gabriela Sanchez, Christian Goosmann, Monika Schmid, Hilmar Berger, Pau Morey, Christian Denecke, Juergen Ordemann e Thomas F Meyer, 21 de fevereiro de 2018, Intestino BMJ.
DOI: 10.1136/gutjnl-2017-314540
