Por favor, avalie esta postagem
Uma molécula chamada MHC-II (vista aqui em verde) disfarça as células metastáticas do câncer de mama (vermelho), permitindo-lhes invadir os gânglios linfáticos e criar raízes sem provocar uma resposta imunológica. Crédito: Laboratório Beyaz/Laboratório Cold Spring Harbor
Os gânglios linfáticos atuam como uma das primeiras linhas de defesa do corpo contra doenças. A partir desses centros de controle orgânico, as células imunológicas são enviadas para a batalha contra invasores estrangeiros. Mas de alguma forma, os gânglios linfáticos também são a primeira parada para a maioria dos cânceres metastáticos.
“É paradoxal”, diz Semir Beyaz, professor assistente do Cold Spring Harbor Laboratory (CSHL). “O câncer entra imediatamente, mas as células imunológicas não fazem nada. É importante entender o que está acontecendo porque é assim que o câncer toma o corpo inteiro como refém.”
Beyaz juntou-se a colaboradores do Massachusetts General Hospital para investigar. Eles descobriram que as células do câncer de mama enganam o sistema imunológico com a ajuda de uma molécula chamada MHC-II. A terapêutica futura direcionada a esta molécula pode ajudar a retardar a propagação do câncer e melhorar os resultados dos pacientes.
“O MHC-II funciona como um passaporte para o cancro da mama”, diz Beyaz. “Isso convence o linfonodo a deixar o câncer entrar e protegê-lo. A partir daí, é um caos.”
Em outros lugares, como no intestino, o MHC-II ajuda a destruir células anormais antes que se tornem um problema. Mas a versão do MHC-II do câncer de mama não carrega os sinais de alerta que as células imunológicas reconhecem. Então, o linfonodo trata isso como um alarme falso. Beyaz explica:
“O câncer sequestra o linfonodo – a delegacia. Os detetives apenas dizem: 'Bem-vindo. Aqui está um sofá confortável. Aqui está um café. O câncer suborna as células vizinhas. Então cresce. Isto é o que o MHC-II está fazendo nas metástases linfonodais.”
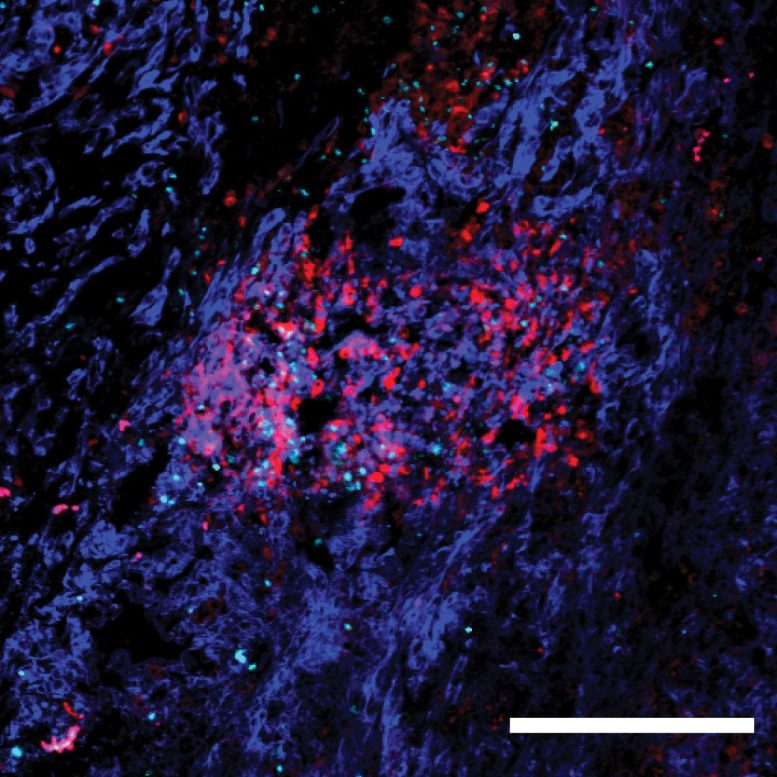
O MHC-II (visto aqui em vermelho) engana o linfonodo para liberar células antiinflamatórias chamadas foxp3 (ciano), que suprimem a resposta imunológica do corpo, permitindo que o câncer de mama metastático se estabeleça. Crédito: Laboratório Beyaz/Laboratório Cold Spring Harbor
A equipe descobriu que, em camundongos, níveis mais elevados de MHC-II em um subconjunto de células cancerígenas levaram a uma maior supressão imunológica nos gânglios linfáticos. Isso causou pior metástase e menor sobrevida. Quando desligaram a produção de MHC-II nas células cancerígenas, os gânglios linfáticos acordaram para a ameaça. Como resultado, o cancro não se espalhou tão rapidamente e os ratos viveram mais tempo.
“Se você eliminar o MHC-II nas células cancerígenas, você reduzirá a invasão”, explica Beyaz. “Os gânglios linfáticos param de suprimir a resposta imunológica e reduzem a capacidade de colonização do câncer.”
Beyaz agora espera revelar exatamente como o câncer se adapta e se espalha. A compreensão desses mecanismos pode nos aproximar de novas terapêuticas bloqueadoras de metástases. Mas, adverte, a eficácia de qualquer medicamento potencial dependerá do local onde o cancro se desenvolve inicialmente.
“Por exemplo, no intestino, vemos o oposto do que acontece no cancro da mama”, explica Beyaz. “Existem regras específicas para cada contexto, e isso nos diz que não existe uma cura para tudo.”
Mais de 300.000 pessoas nos EUA serão diagnosticadas com câncer de mama somente neste ano. Embora ainda haja uma longa jornada pela frente, Beyaz acredita que esta pesquisa poderá algum dia ter implicações clínicas que levem a melhores terapias e melhorem a vida dos pacientes.
Referência: “A plasticidade das células cancerosas e a tolerância imunológica mediada pelo MHC-II promovem a metástase do câncer de mama para os gânglios linfáticos” por Pin-Ji Lei, Ethel R. Pereira, Patrik Andersson, Zohreh Amoozgar, Jan Willem Van Wijnbergen, Meghan J. O'Melia , Hengbo Zhou, Sampurna Chatterjee, William W. Ho, Jessica M. Posada, Ashwin S. Kumar, Satoru Morita, Lutz Menzel, Charlie Chung, Ilgin Ergin, Dennis Jones, Peigen Huang, Semir Beyaz e Timothy P. Padera, 21 de junho 2023, Revista de Medicina Experimental.
DOI: 10.1084/jem.20221847
O estudo foi financiado pelo Instituto Nacional de Saúdeum prêmio Rullo Family MGH Research Scholar, Oliver S. e Jennie R. Donaldson Charitable Trust, G. Harold e Leila Y. Mathers Charitable Foundation, Mark Foundation For Cancer Research, Chan Zuckerberg Initiative, Silicon Valley Community Foundation , o STARR Cancer Consortium, o Cold Spring Harbor Laboratory, a Northwell Health, o New York Genome Center, o Deutsche Forschungsgemeinschaft Walter Benjamin Programme e a Agency for Science, Technology and Research (A*STAR).
