Por favor, avalie esta postagem
Um novo estudo do Salk Institute apresenta um método contraceptivo masculino não hormonal e reversível inovador que utiliza inibidores de HDAC para bloquear a produção de espermatozoides sem afetar a libido. Este método, que visa a regulação da expressão genética na produção de espermatozóides, promete menos efeitos secundários e uma fertilidade totalmente reversível, indicando um avanço significativo no desenvolvimento de contraceptivos masculinos.
A administração de um inibidor de HDAC por via oral interrompeu a produção de espermatozoides e a fertilidade em camundongos sem afetar sua libido.
Pesquisas mostram que a maioria dos homens nos Estados Unidos está interessada em usar contraceptivos masculinos. Contudo, suas escolhas estão atualmente restritas aos preservativos menos confiáveis ou às vasectomias mais intrusivas. Os esforços para criar medicamentos que inibem a produção, o desenvolvimento ou a capacidade de fertilização dos espermatozoides alcançaram até agora um sucesso modesto, muitas vezes resultando em eficácia parcial ou efeitos adversos significativos. A complexidade do desenvolvimento do esperma representa um desafio significativo para os cientistas que tentam inovar no campo da contracepção masculina, uma vez que continua difícil encontrar aspectos do processo que possam ser alterados de forma segura e eficaz.
Agora, cientistas do Instituto Salk descobriram um novo método de interromper a produção de espermatozóides, que é não hormonal e reversível. O estudo, publicado em Anais da Academia Nacional de Ciências (PNAS) em 20 de fevereiro de 2024, implica um novo complexo proteico na regulação da expressão gênica durante a produção de espermatozoides. Os investigadores demonstram que o tratamento de ratos machos com uma classe existente de medicamentos, chamados inibidores da HDAC (histona desacetilase), pode interromper a função deste complexo proteico e bloquear a fertilidade sem afectar a libido.
Uma abordagem inovadora
“A maioria dos medicamentos experimentais contraceptivos masculinos usam uma abordagem de martelo para bloquear a produção de espermatozóides, mas a nossa é muito mais sutil”, diz o autor sênior Ronald Evans, professor, diretor do Laboratório de Expressão Gênica e Cátedra March of Dimes em Biologia Molecular e do Desenvolvimento na Salk. “Isso a torna uma abordagem terapêutica promissora, que esperamos ver em breve em desenvolvimento para testes clínicos em humanos.”
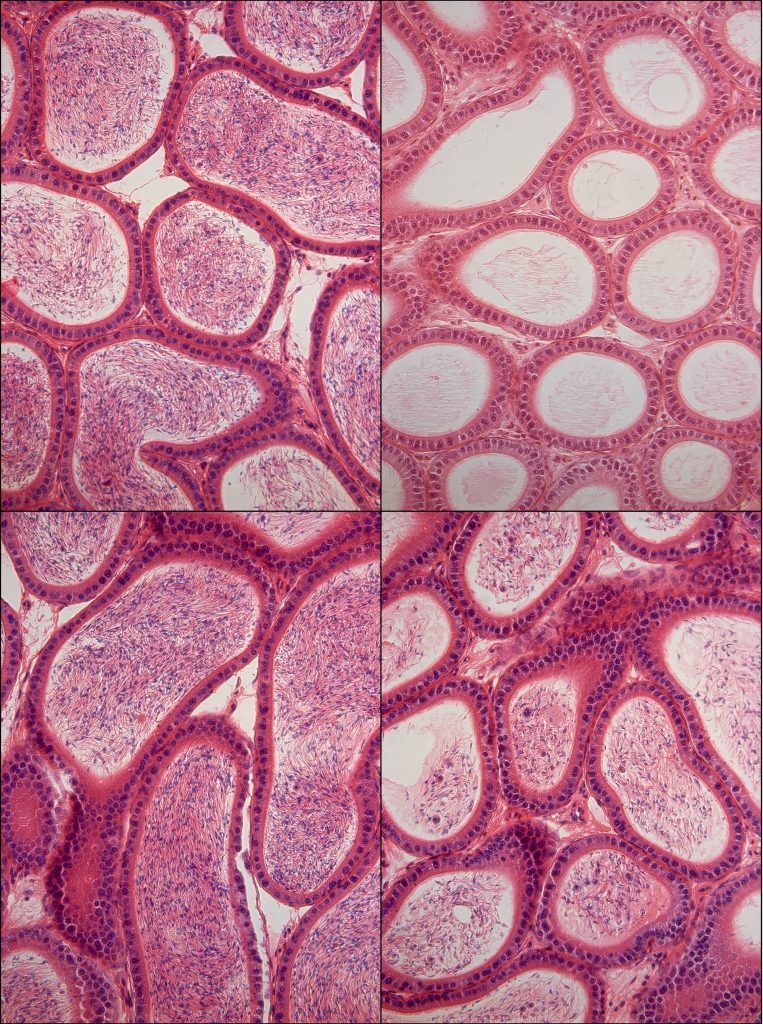
Os espermatozoides, retratados dentro do tubo transversal do epidídimo, não foram gerados enquanto os camundongos tomavam o medicamento inibidor de HDAC (canto superior direito), mas após 60 dias sem o medicamento, a espermatogênese foi recuperada (canto inferior direito). A coluna da esquerda mostra espermatozoides ao mesmo tempo em um camundongo que não recebeu a droga. Crédito: Instituto Salk
O corpo humano produz vários milhões de novos espermatozoides por dia. Para fazer isso, as células-tronco espermáticas nos testículos produzem continuamente mais de si mesmas, até que um sinal lhes diga que é hora de se transformarem em espermatozoides – um processo chamado espermatogênese. Este sinal vem na forma de retinóico ácidoum produto da vitamina A. Pulsos de ácido retinóico ligam-se aos receptores de ácido retinóico nas células e, quando o sistema está alinhado corretamente, inicia um programa genético complexo que transforma as células-tronco em espermatozoides maduros.
Os cientistas da Salk descobriram que, para que isso funcione, os receptores do ácido retinóico devem se ligar a uma proteína chamada SMRT (mediador silenciador dos receptores do retinóide e do hormônio tireoidiano). A SMRT então recruta HDACs, e esse complexo de proteínas sincroniza a expressão dos genes que produzem espermatozoides.
Intervenção direcionada sem efeitos colaterais
Grupos anteriores tentaram interromper a produção de espermatozoides bloqueando diretamente o ácido retinóico ou seu receptor. Mas o ácido retinóico é importante para vários sistemas orgânicos, pelo que interrompê-lo em todo o corpo pode levar a vários efeitos secundários – uma razão pela qual muitos estudos e ensaios anteriores não conseguiram produzir um medicamento viável. Em vez disso, Evans e seus colegas perguntaram se poderiam modular uma das moléculas a jusante do ácido retinóico para produzir um efeito mais direcionado.
Os pesquisadores analisaram primeiro uma linha de camundongos geneticamente modificados que haviam sido desenvolvidos anteriormente em laboratório, nos quais a proteína SMRT sofreu mutação e não conseguia mais se ligar aos receptores do ácido retinóico. Sem essa interação SMRT-receptor de ácido retinóico, os camundongos não foram capazes de produzir espermatozoides maduros. No entanto, eles exibiram níveis normais de testosterona e comportamento crescente, indicando que o seu desejo de acasalar não foi afetado.

A partir da esquerda: Ruth Yu, Suk-Hyun Hong, Ronald Evans, Annette Atkins e Michael Downes. Crédito: Instituto Salk
Para ver se conseguiriam replicar estes resultados genéticos com intervenção farmacológica, os investigadores trataram ratos normais com MS-275, um inibidor oral de HDAC com estatuto de avanço da FDA. Ao bloquear a atividade do complexo SMRT-receptor de ácido retinóico-HDAC, a droga interrompeu com sucesso a produção de espermatozoides sem produzir efeitos colaterais óbvios.
Outra coisa notável também aconteceu quando o tratamento foi interrompido: 60 dias após a suspensão da pílula, a fertilidade dos animais foi completamente restaurada e todos os descendentes subsequentes apresentavam desenvolvimento saudável.
Efeitos reversíveis e implicações futuras
Os autores dizem que a sua estratégia de inibição de moléculas a jusante do ácido retinóico é fundamental para alcançar esta reversibilidade.
Pense no ácido retinóico e nos genes produtores de esperma como dois dançarinos numa valsa. Seu ritmo e passos precisam ser coordenados entre si para que a dança funcione. Mas se você adicionar algo que faça os genes perderem um passo, os dois ficam subitamente fora de sincronia e a dança desmorona. Neste caso, o inibidor HDAC causa o erro dos genes, interrompendo a dança da produção de espermatozóides.
Porém, se o dançarino conseguir se equilibrar e voltar ao ritmo do parceiro, a valsa pode ser retomada. Da mesma forma, os autores dizem que a remoção do inibidor de HDAC permite que os genes produtores de espermatozoides voltem a sincronizar-se com os pulsos de ácido retinóico, reativando a produção de espermatozoides conforme desejado.
“É tudo uma questão de tempo”, diz o coautor Michael Downes, cientista sênior do laboratório de Evans. “Quando adicionamos o medicamento, as células-tronco ficam fora de sincronia com os pulsos do ácido retinóico e a produção de espermatozoides é interrompida, mas assim que retiramos o medicamento, as células-tronco podem restabelecer sua coordenação com o ácido retinóico e a produção de esperma. vai começar de novo.”
Os autores dizem que a droga não danifica as células-tronco dos espermatozoides ou sua integridade genômica. Enquanto a droga estava presente, as células-tronco espermáticas simplesmente continuaram a se regenerar como células-tronco e, quando a droga foi posteriormente removida, as células puderam recuperar sua capacidade de se diferenciar em espermatozóides maduros.
“Não estávamos necessariamente procurando desenvolver contraceptivos masculinos quando descobrimos a SMRT e geramos esta linhagem de camundongos, mas quando vimos que sua fertilidade foi interrompida, fomos capazes de seguir a ciência e descobrir um potencial terapêutico”, diz o primeiro autor Suk- Hyun Hong, pesquisador do laboratório de Evans. “É um ótimo exemplo de como a pesquisa biológica fundamental de Salk pode levar a um grande impacto translacional.”
Referência: “Alvejando corepressores de receptores nucleares para contracepção masculina reversível” por Suk-Hyun Hong, Glenda Castro, Dan Wang, Russell Nofsinger, Maureen Kane, Alexandra Folias, Annette R. Atkins, Ruth T. Yu, Joseph L. Napoli, Paolo Sassone -Corsi, Dirk G. de Rooij, Christopher Liddle, Michael Downes e Ronald M. Evans, 20 de fevereiro de 2024, Anais da Academia Nacional de Ciências.
DOI: 10.1073/pnas.2320129121
Outros autores incluem Glenda Castro, Dan Wang, Russell Nofsinger, Annette R. Atkins e Ruth T. Yu de Salk, Maureen Kane, Alexandra Folias e Joseph L. Napoli da UC Berkeley, Paolo Sassone-Corsi da UC Irvine, Dirk G . de Rooij, da Universidade de Utrecht, e Christopher Liddle, do Universidade de Sydney.
O trabalho contou com o apoio do Instituto Nacional de Saúde (concede CA265762 e CA220468) e os núcleos de sequenciamento e citometria de fluxo de próxima geração em Salk, financiados pelo Salk Cancer Center (concessão NCI NIH-NCI CCSG: P30 014195).
